
2022年7月5日,国际权威生物学杂志Oxidative Medicine and Cellular Longevity (IF=7.31)发表了复旦大学附属金山医院肿瘤科乔田奎教授团队的最新研究成果“Activation of the P62-Keap1-NRF2 Pathway Protects against Ferroptosis in Radiation-induced lung injury”。
本研究成功探索了建立放射性肺损伤体外细胞模型的条件,探讨了铁死亡在放射性肺损伤发生发展中的作用。该研究证实了P62-Keap1-NRF2信号通路参与调控RILI中的铁死亡,并全面探讨了P62-Keap1-NRF2信号通路各部分具体调控关系。研究发现铁死亡特异性抑制剂Lip-1、Fer-1可以进一步上调RILI中NRF2信号通路,抗氧化蛋白生成增多,减少了ROS水平,抑制铁死亡发生,最终抑制RILI发生发展。

研究背景
放射性肺损伤(radiation-induced lung injury, RILI)是肺癌患者放疗的常见并发症。射线电离产生的活性氧(reactive oxygen species, ROS)在RILI的发生发展过程中发挥重要作用,但是对于ROS以何种方式损伤肺泡上皮细胞导致RILI,以及其具体损伤机制方面的研究尚未深入。铁死亡(Ferroptosis)是一种新发现的以细胞内铁依懒性活性氧异常增高,氧化还原稳态失衡为特征的细胞死亡方式。课题组前期研究结果发现射线电离产生的大量ROS在RILI的发生过程中发挥着根本作用,RILI的发生过程中GPX4的表达同样下降明显,提示放射线可能通过介导肺泡上皮细胞内铁死亡方式引发RILI,对此国内外尚未有研究。通过激活P62-Keap1-NRF2信号通路可以抑制细胞内铁死亡发生,NRF2信号通路也是调控细胞铁死亡发生的重要途径。因此,本课题组提出假说:射线电离产生的ROS介导肺泡上皮细胞以铁死亡的细胞死亡方式诱导RILI发生,P62-Keap1-NRF2信号通路参与其中过程,并发挥重要调控作用。
研究发现
本研究成功建立了RILI体外模型,证实了射线电离产生大量ROS,损伤肺泡上皮细胞,介导铁死亡发生,引起RILI;电离产生大量ROS可以激活机体内源性P62-Keap1-NRF2抗氧化信号通路,但NRF2通路表达水平升高幅度不高,通过干预进一步激活P62表达上调,降低了Keap1表达水平,Keap1-NRF2解离,NRF2转入核内表达,抗氧化蛋白生成增多,ROS水平下降,最终抑制铁死亡发生,提示P62-Keap1-NRF2信号通路参与调控RILI中的铁死亡。铁死亡特异性抑制剂Fer-1、Lip-1可进一步上调RILI中的NRF2信号通路,促进抗氧化蛋白表达,减少ROS生成,抑制铁死亡发生,其作用位点可能是NRF2,而对上游的P62、Keap1表达无影响。
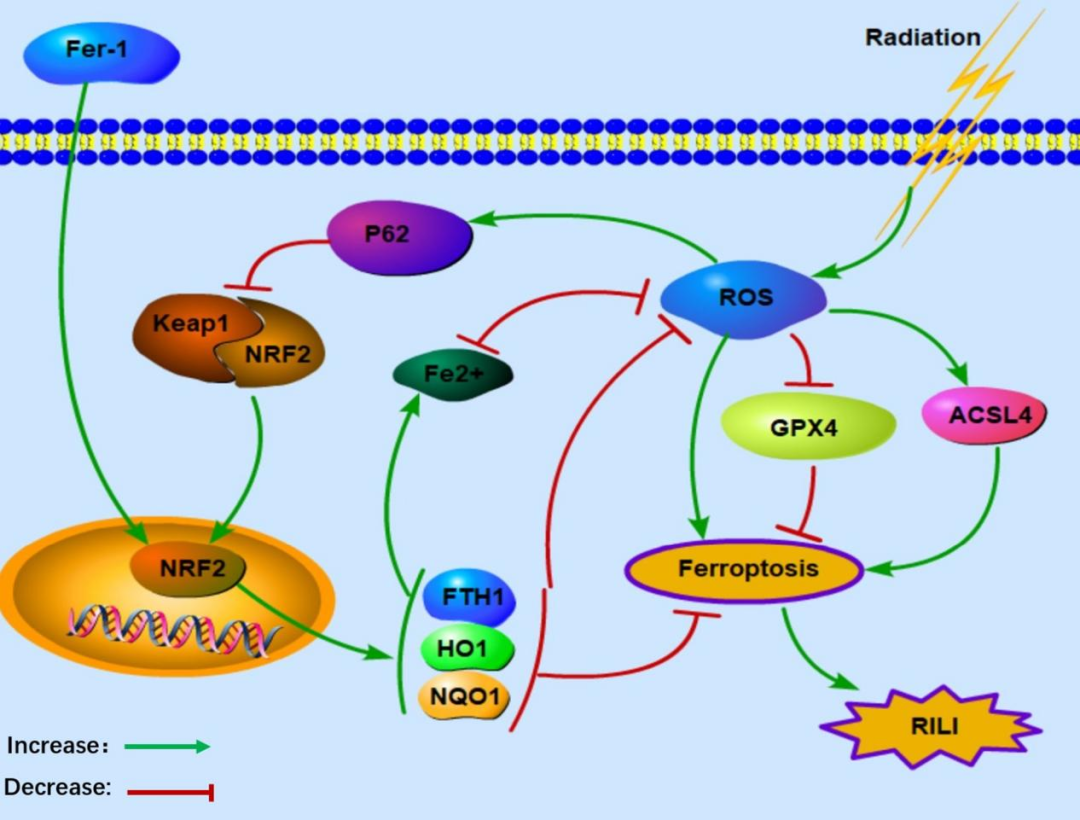
该研究是在上海市科委基金项目(NO. 201409001100)和国自然青年项目(NO. 81800079)的资助下完成。复旦大学附属金山医院肿瘤科乔田奎主任医师为通讯作者,肿瘤科主治医师李轩为第一作者。

医学探索永远在路上,
闪光金医科研人,
快乐分享研究成果,
更多金医科研前沿,
敬请期待!